致癌性人乳头瘤病毒 (HPV) 检测和HPV16或HPV18基因型分析用于25岁及以上女性宮颈癌筛查:ATHENA研究的亚组分析
Philip E Costle Mark H Stole, Thomas C Wright Jr, Abha Sharma, Teresa L Wright Catherine M Behrens
www.thelancet.com/oncology 第12卷2011年9月
ATHENA研究注册地址: ClinicalTtrials. gov,编号:NCT00709891

Athena研究:
-Addresing The Need for Advanced HPV diagnostics(解决高级HPV诊断的需求),是迄今为止,在美国进行宫颈癌筛查HPV DNA检测与液基细胞学检查方法评价规模最大的临床试验”
HPV=入乳头瘤病毒;CIN2或CN3=2或3级子官颈上皮内瘤变: ASC-US=意义不明确的非典型鳞状细胞异常
概述
背景
ATHENA研究以美国宫颈癌筛查≥21岁人群为研究对象,以液基细胞学方法为参照,对致癌性人乳头瘤病毒 (HPV) 检测,以及HPV16或HPV18基因型检测性能进行评价。我们对上述人群进行了一项亚组分析,选择对象为≥25岁妇女,对 cobas HPV检测与液基细胞学检查方法筛査性能进行比较评价,并对HPV阳性妇女管理策略进行评价。
方法
研究纳入的常规宫颈癌筛查的≥25岁妇女来自美国23个州的61所临床研究中心。获取的宫颈癌样本用于液基细胞学检查、 HPV DNA检测,DNA检测方法有两种,分别是第一代检测方法 ( Amplicor HPV检测与 Linear Array HPV基因型分析) 与第二代 cobas HPV检测方法 (个体化HPV16与HPV18检测) ,对意义不明的非典型状细胞 (ASC-US) 或更严重细胞学异常妇女,以及随机选择的HPV与细胞学检查阴性妇女进行阴道镜检查与诊断性活检,ASC-US或更严重细胞学异常妇女样本第一代两种方法的HPV检测均呈阳性结果。所有未被納入至阴道镜检查的妇女接收检测结果,并退出研究。基于双百原则,研究对象及阴道镜检查医生均不知细胞学检查与HPV检测结果,直至阴道镜随访研究结束。此亚组研究主要研究终点是对宫预上皮内籀变3级 (CIN3) 或更严重病变的组织学确认。本研究注册地址:Clinicaltrials.gov, 编号:NCT00709891; 研究目前处于随访阶段,预计2012年12月完成。
结果
2008年5月27日至2009年8月27日,研究共纳入47208名妇女,其中41955名可满足我们的入选标准。40901名妇女 (97%) cobas HPV与液基细胞学检查结果有效、可用,并被纳入至此亚组分析中,其中,4275名妇女 (10%) cobas HPV检测阳性,2617名妇女 (6%) 细胞学检查结果异常。431名妇女被诊断为CN2或更严重病变,274名妇女被诊断为CN3或更严重病变。阴道镜检查妇女中,CIN3或更严重病变诊断中,与液基细胞学方法相比, cobas HPV检测敏感性更高 (252/274 [92.0%,95%CI 88.1-94.6]对146/274 [53.3.0%,95%CI 47.4-59.1]差异38.7%,95%CI 31.9-45.5; P<0.0001)。与单独HPV检测相比,在HPV检测基础上联合进行液基细胞学检查,CIN3或更严重病变检测敏感性提高达96.7% (265/274,95%C1 93.9-98.3) ,阳性查量增加35.2% (5783/40901对4275/40901) 。作为一种确认HPV阳性妇女CN3或更严重病变的分流检测,单独HPV16、HPV18基因型检测,或两种联合检测与单独 ASC-US或更严重细胞学异常检测敏感性 (150/252 [59.5%]对133/252 [52.8%]:p=0.11) 与阳性预测值 (PPV) (150/966 [15.5%]对133/940 [14.1%]:p=0.20) 相当。HPV阳性妇女中,与ASC-US或更严重细胞学异常单独细胞学检査相比,用于CIN3或更严重病变诊断的单独HPV16、HPV18检测或两种联台检测,或低级别鳞状上皮内病变或更严重病变细胞学检查敏感性更(182/252 [72.2%]; P<0.0001) ,PPV相同 (182/1314[13.9%]:p=0.70) 。而且,与ASC-US或更严重细胞学异常单独细胞学检查相比,单独HPV16、HPV18检测,或两种联合检测,或高级别鳞状上皮内病变或更严重病变细胞学检查敏感性 (165/252[65.5%]:p=0.0011) 与PPV更高 (165/1013[16.3%]:p=0.031)。
结论
与仅基于细胞学的检查方法相比,HPV检测联合HPV16与HPV18检测敏感性更高,进行宫颈癌筛查更加有效,可作为替代方法使用
资助方 罗氏分子系统公司
前言
宫颈细胞学检查经历了最初的 Papanicolaou (Pap) 涂片检查,到目前的液基细胞学检查的转变,液基细胞学检查己经成为发达国家宫颈癌筛查的常规方法。自从20世纪中期引进液基细胞学检查方法以来,所有成功进行液基细胞学筛查的国家及地区的宫颈发病率显若降低。美国宫颈癌非常少见,估计2010年新发病例数是12200例,相关死亡病例4210例。尽管液基细胞学检查比较成功由于一次性筛查敏感性较低,目前,人们普遍认为以细胞学为基础的筛查效率不高,因此,为获得实际敏感性,人一生需要进行多次筛查。美国宫颈症筛查与预防项目每年耗费大约40亿美元。
因此,更有效的筛查方法应具有理想的比较性能与成本效益比。与一次性细胞学筛查方法相比,人乳头瘤病毒(HPV)DNA检测的子宫颈癌及癌前病变检测敏感性更高,因此, HPV DNA检测成为首选癌前病变检测方法。早期检测可降低宫颈癌预期风险,以及相关死亡率,因此,与细胞学检查相比,DNA检测可使筛查阴性妇女更加安心,这样,与液基细胞学检查相比,在保证安全的前提下,HPV检测间隔时间可延长。HPV检测比液基细胞学检查敏感性高,也可用于腺体癌(腺癌)以及其癌前体(原位腺癌)的检测,由于美国、加拿大,以及欧洲的腺癌发病率增高,腺癌及其癌前体的检测越来越重要。
因此,检测方法向HPV检测的转变,或单独HPV检测,或联合细胞学检查(协同检测),将使筛査更加安全、更加有效。HPV检测或与细胞学检查行联合检测,或作为宫颈癌筛查初级检测方法均是HPV阳性妇女管理中的一项重要的、关键性考虑。根据美国官方指南,应该于1年内,再次对≥30岁HPV阳性,具有正常宫颈细胞学检查结果的妇女(上皮内病变或恶性病变阴性[NILM])进行宫颈癌筛查。此方法不是最佳方法,因为部分HPV阳性,阴性细胞学检查结果的妇女在随访期间会脱落,“再次筛查间隔期间,小部分可能会进展为浸润癌。由于HPV检测存在这种局限性,需要对HPV阳性的,具有NILM细胞学检查结果的妇女进行分层处理,确定宫颈癌前病变最高风险妇女,并担保进行即时阴道镜检查。建议将单独HPV16、HPV18基因型,或联合两种基因型检测作为一种分流策略,因为这两种HPV基因型与大约70%的浸润性宫颈癌具有相关性,但有关单独HPV16、HPV18基因型,或联合两种基因型检测临床性能的可用临床试验证据很少。
美国食品药品监督管理局(FDA)已批准三种DNA检测用于致癌性或高风险性HPV检测,分别是:Hybrid Capture 2 (Qiagen, Gaithersburg, MD,USA: 2003)、 Cervista HPV HR (Hologic, Bedford,MA,USA:2009),与cobas HPV检测( Roche Molecular Systems, Pleasanton, CA. USA: 2011)。cobas HPV检测是全自动HPV DNA检测,于三个相互隔离的通道进行检测,分别是:独立性HPV16通道、独立性HPV18通道,与混合性12种其他HPV基因型通道(11种明确的高风险基因型加上1种可能是高风险的基因型)。此后,HPV即指致癌性或高风险HPV基因型。
ATHENA (Addressing The Need for Advanced HPV diagnostics) (解决高级HPV诊断的需求) 研究是迄今为止,在美国进行宫颈癌筛查HPV DNA检测与液基细胞学检查方法评价规模最大的临床试验。研究项目主要针对三种人群进行研究:(1)细胞学检查存在意义不明的非典型鳞状细胞异常(ASC-US)的≥21岁妇女,对主要用于ASC-US阴道镜分流的实验性能进行评价,前期已经有所报道; (2)细胞学检査查结果为NILM的≥30岁妇女对细胞学检查辅助检测的实验性能进行评价: (3)任意细胞学检查结果(即与细胞学检查结果无关),≥25岁妇女,对作为初级筛查实验的HPV检测联合基因型检测性能进行评价。这里,我们展示的是上述第三类人群的 cobas HPV检测数据。
方法
研究人群
常规宫颈癌筛查妇女被纳入至ATHENA研究中,研究场所位于美国23个州的61所临床研究中心(网络附录页码1)。入选妇女年龄≥21岁,非孕妇。前期己经对研究纳入与排除标准进行描述,简言之,入选妇女必须子宫完好,12个月研究纳入期间未进行CIN治疗,目前未参与或未计划参与HPV治疗临床试验。此亚组分析人群仅限于≥25岁妇女。
研究方案已得到所有研究场所伦理审查委员会批准,所有妇女参与研究前均己签署知情同意书。伦理审查委员会项目编号:MWP-HPV159,于2008年3月13日获取。
程序
两份液基细胞学宫颈癌筛查样本采自随访1(纳入随访)的研究对象,放置于 PreservCyt中(美国马萨诸塞州 Bedford的 Hologic公司),使用ThinPrep( Hologic)进行处理。其中一份样本用于液基细胞学检查与HPV检测。HPV检测有三种实验(美国加州Pleasanton的罗氏分子系统公司),分别是: 第一代 Amplicor HPV检测、第一代 LinearArrav HPV基因型检测,以及第二代 cobas HPV检测。保存第二份样本用于其他检测。对于上述分析来说,cobas HPV检测基因型16、基因型18,或16与18阳性结果均被视为HPV16或HPV18阳性,或16与18阳性,即使该样本检测12种其他的高风险HPV基因型也是阳性。按照2001 Bethesda系统命名进行细胞学检查结果报告。于美国4所临床实验室进行样本处理与检测,第5所实验室也位于美国,仅进行cobas HPV检测,检测程序见前期描述。根据临床研究场所纳入的思者数量与次序,以及实验室检测能力,进行样本的实验室检测分配,样本分配不是基于地理位置。根据研究随访1的液基细胞学检查结果,以及第一代HPV检测结果,由随机化中心确认进行阴道镜检查的妇女。具有ASC-US或更严重细胞学异常(阳性) 宫颈细胞学检查结果,或任意检测HPV阳性,及具有NILM宮颈细胞学检查结果的妇女为阴道镜检査入选妇女。对一部分随机选择的HPV阴性,以及具有NILM宫预细胞学检查结果的妇女子集也进行阴道镜检查,该子集随机化由SAS软件(版本9.1.3)进行,控制块大小是35。未入选阴道镜检查妇女接收结果,并退出研究。
根据标准化方案,纳入随访(研究随访2)12周内,进行阴道镜检查、活检,或宫颈内搔刮术。基于盲法原则,研究对象与阴道镜检查医生均不知道细胞学检查结果与HPV检测结果,直至阴道镜检查随访结束。由三名病理学专家组成的专家小组对活检以及宫颈内搔刮结果进行审核(中心病理学评议),专家小组成员对细胞学检查结果与HPV检测结果均不知情,根据诊断标准,按照宫颈上皮内瘤变(CIN)术语进行诊断。 ATHENA研究主要研究终点是活检确认的2级CIN(CIN2)或更严重病变。24阴道镜检查随访后,达到此研究终点的妇女退出研究,并进行治疗,未达到CIN2研究终点的妇女可入选临床试验纵向随访期、纵向随访期研究预计2012年12月结束。然而,对于此亚组分析来说,我们将CIN3或更严重病变作为主要研究终点,因为与CIN2或更严重病变相比,CIN3是一种更加明确、可靠的组织学癌前病变诊断。研究数据也用于CIN2或更严重病变,CIN2是标准治疗阅值,25将CIN2作为次要研究终点,CIN2具有同等的癌前病变诊断效力、介于CIN1与CN3之间。26-28CIN2重现性较差,非致癌性UPV基因型也可导致CIN2与CIN3相比,缓解概率很大。
统计分析
ASC-US联合HPV检测(辅助性)注册临床试验(即: 获取ASC-US Pap检查结果后,于宫样本中进行HPV检测)29-30中,根据样本量,我们对大约70名具有ASC-US细胞学检查结果的妇女数据进行计算,这些妇女已经被诊断为组织学CIN2或更严重病变、将需要进行 cobas HPV检测)验证。结台已发表总体人群ASC-US细胞学检查结果31与HPV阳性率30,我们的计算结果表明,大约需要45000名妇女的样本量。据预先估算,NILM人群≥30岁妇女中、880名妇女的样本量约有95%的检验效能来检出基线时HPV16阳性或HPV18阳性或两者均阳性与HPV阴性妇女的疾病(CIN2或更严重)差异,约有98%的检验效能来检出3年研究期间HPV阳性与HPV阴性妇女的疾病差异。
有几种指标用于宫颈癌与癌前病变HPV检测与液基细胞学检查性能评价,与细胞学检查方法进行比较,分别是:敏感性、特异性、阳性预测值(PPV)、阴性预测值(NPV)、阳性相似比(PLR)、明性相似比(NLR),与相对风险(RR)。所有结果均用于 cobas HPV检测・而不是第一代 Amplicor或 Linear Array HPV检测。计算性能估算,包括具有95%CI的粗略及修正的用于可能验证偏差矫正的抽样比。粗略估算基于具有疾病验证有效结果的妇女数据。为进行验证偏差调整,我们对具有CIN3或更严重病变(或CIN2或更严重病变),并己进行阴道镜验证的妇女数量进行计算,并将此估测值投射至相应未验证妇女中。我们通过 McNemar的χ2检验,进行租略敏感性、特异性差异检验,按照Leisenring及其同事文献中描述的方法,进行PPV与NPV差异检验。对于验证偏差修正估测来说,通过 bootstrapping(1000次)进行95%CI估测。使用SAS软件包(版本9.1.3)进行所有统计学分析。
对联合HPV16或HPV18基因型,或两种基因型cobas HPV检测,以及不同细胞学解读(ASC-US或更严重细胞学异常、低级别鳞状上皮内病变[LSIL]或更严重病变,或高级别鳞状上皮内病变[HSIL]或更严重病变)阈值进行评价,确认用于即时阴道镜检查分流的更好算法,避免递延管理问题。为解除临床医生的主要顾虑,我们对疾病检测感性与阳性筛查PPV进行评价。作为一种回顾性分析,我们进行了数据分层处理,将分层处理作为对分流方法可靠性的定性评价,数据分层工作由提供HPV与液基细胞学检查结果的4所实验室进行,有1所实验室仅进行HPV检测,被排除在外,可靠性也是检测性能的重要特征之。
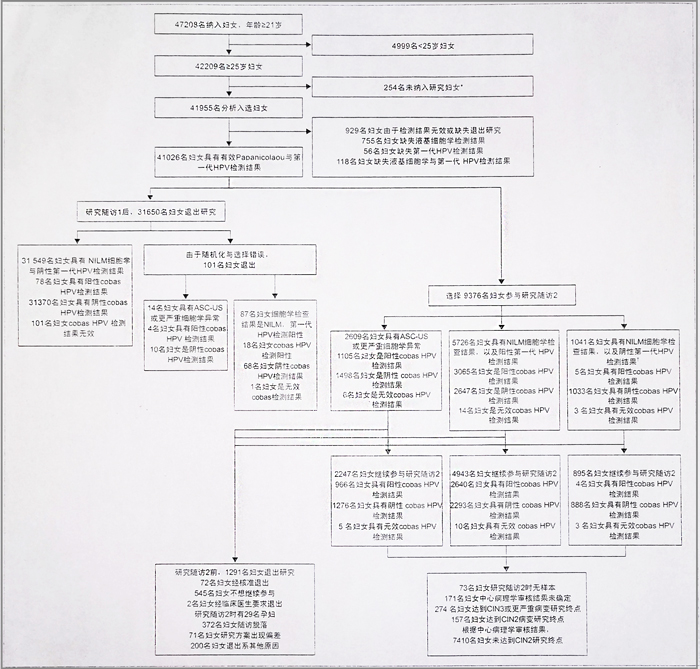
图1 研究概况
第一代HPV检测是 Amplicor与 Linear- Array HPV检测。NILM=上皮内病变或瘤变阴性。ASC-US=意义不明的非典型鳞状细胞。CIN2或CN3=子宫颈上皮内瘤変2级或3级。165名妇女未满足纳入或排除标准,82名妇女多次被纳入至研究中,7名妇文经核准退出研究。随机选则妇女参与研究随访2。
撰写工作中的分工
研究申办方咨询其他研究人员(PEC、MHS与 ICWJr)后,进行研究设计,并负责研究项目实施与数据收集。由申办方(AS、 Guili Zhang、TLW,与CMB)协助PEC进行数据分析。
申办方参与数据解读工作。研究申办方(AS、TLW,与CMB)辅助进行论文编辑与审核。PEC具有所有此亚组分析数据访问权限,进行分析方法设计,并负责决定最终的论文发表提交事宜。
结果
2008年5月27日至2009年8月27日,ATHENA研究共纳入47208名≥21岁妇女。4209名≥25岁妇女被纳入至我们的亚组分析中,其中41955(99%)名妇女满足入选标准(图)。表1是该人群特征描述。纳入随访后,9376名妇女被选择或随机分配进行阴道镜检查(2609名妇女具有ASC-US或更严重细胞学检查结果; 5726名妇女具有第一代HPV检测与NILM子宫颈细胞学检查阳性结果;1041[32590名妇女的3%]名妇女HPV检测与NILM子宫颈细胞学检查阴性)。2247名ASC-US或更严重细胞学异常妇女进行阴道镜检查,其中4943名妇女HPV检测阳性,895名妇女HPV与细胞学检查结果阴性:研究随访2前,1291名妇女退出研究。
41955名入选妇女中,1054名妇女检测结果缺失或无效,其中929名妇女缺失液基细胞学检查结果或第一代HPV检测结果,或两种检查结果均缺失(其中143名妇女也具有无效 cobas HPV检测结果),125名妇女仅具有无效 cobas HPV检测结果。因此40901名妇女(97%)所有检测有效数据均可用。
根据检测结果粗略数据(验证偏差未矫正),10% (4275/40901)的妇女cobas HPV检测阳性,6%(2617/40901)的妇女具有异常ASC-US或更严重细胞学异常细胞学检查结果(表2:差异4.1%,95%C1 3.7-4.4: p<0.0001)。2617名妇女即2609名选择参与研究随访2妇女,减去6名无效cobas HPV检测结果妇女,加上14名由于随机化误差退出研究的妇女。粗略患病率较低,1.1%(431/40901)的妇女诊断为CIN2或更严重病变,0.7%6(274/40901)的妇女诊断为CIN3或更严重病变。值得注意的是,诊断为CIN3的妇女中,92%(234/254)HPV检测阳性,52%(132/254)具有ASC-US或更严重液基细胞学检查结果(差异:40290959C331-472:P<0.0001)。同样,诊断为CIN2的妇女中,82%(128/157)HPV检测阳性,48%(76/157)具有ASC-US或更严重细胞学异常液基细胞学检查结果(差异: 33.1%, 95%CI 24.0-42.2: p<0.0001)。
阴道镜检查妇女中,以ASC-US或更严重细胞学异常为阈值(表3:差异38.7%,95%CI 31.9-45.5: p<0.0001),与液基细胞学检查相比,CIN3或更严重病变HPV检测敏感性更高,特异性较低(差异:16.0%,95%CI 14.5-17.6: p<0.0001)。验证偏差修正后,两种检测方法敏感性降低显著: 与液基细胞学检查相比,CIN3或更严重病变HPV检测敏感性更高,但特异性较低(表3)。RR数据显示,与液基细胞学检査方法相比,HPV检测阳性与CIN3或更严重病变相关性更高: 与液基细胞学检查相比,HPV检测与NLR的相关性较低(表3)。CIN2或更严重病变研究终点同样可见上述模式(表3)。与单独HPV检测相比(252/274[92.0%,95%CI 88.1-94.6]:表3),液基细胞学检查联合HPV检测,CIN3或更严重病变检测敏感性仅提高4.7%(95%CI 2.8-8.0),达到96.7%(265/274,95%CI 93.9-98.3),阳性筛査数量提高35.2%(5783对40901中的4275)。
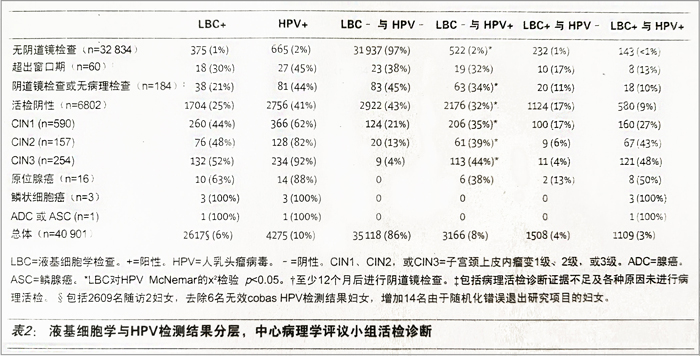
表2 液基细胞学与HPV检测结果分层, 中心病理学评议小组活检诊断
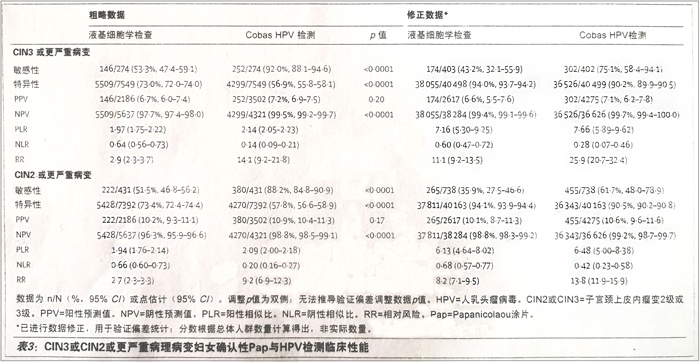
表3 CIN3或CIN2或更严重病理病变妇女确认性Pap与HPV检测临床性能
我们对液基细胞学检査联合单独HPV6、HPV18基因型,或两种基因型检测对HPV阳性妇女进行阴道镜检査分流策略进行了审核(表4)。通过与单独ASC-US或更严重细胞学异常检测比较,唯一可用的进行我们对液基细胞学检査联合单独HPV6、HPV18基因型,或两种基因型检测对HPV阳性阴道镜检査分流的方法一一单独HPV16、HPV18基因型,或两种基因型联合检测敏感性及PPV均较高,但差异不显著(表4)。在ASC-US或更严重细胞学异常分流策略基础上,辅助进行单独HPV16、HPV18,或两种基因型联合检测,检测敏感性进一步提高,但PPV降低(表4)。值得注意的是,HPV阳性、具有NILM细胞学检查结果的≥25岁妇女CIN3或更严重病变检测中,单独HPV16、HPV18,或两种基因型阳性检测敏感性提高53.8%(64/119,95%CI 44.9-62.5),PPV提高10.2% (64/629,95%CI 8.1-12.8)。以LSIL或更严重病变作为阈值,与ASC-US或更严重细胞学异常检测相比,单独HPV16、HPV18基因型,或两种基因型联合检测敏感性提高,PPV不变(表4)。而且,与单独ASC-US或更严重细胞学异常检测相比,HSIL或更严重病变单独HPV16、HPV18基因型,或两种基因型检测敏感性与PPV较高。同样模式也记录于CIN2或更严重病变终点研究中,例外的是,与单独ASC-US或更严重细胞学异常检测相比,单独HPV16、HPVI8基因型或两种基因型检测敏感性或PPV并不高,尽管差异不显著。将HSIL或更严重病变检测作为一种附加或替代分流策略,进行单独HPV16、HPV18或联合检测,与单独ASC-US或更严重细胞学异常检测相比,检测敏感性与PPV均增加,但差异不具有统计学意义(表4)。
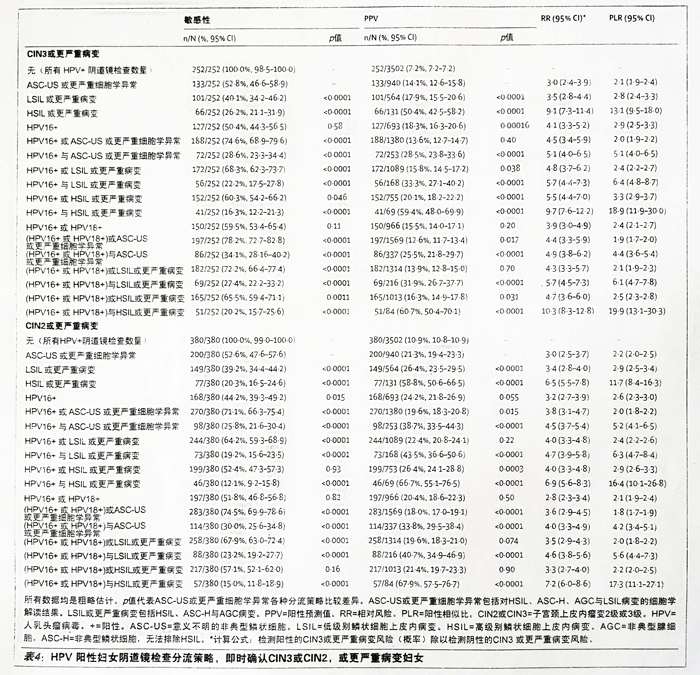
表4 HPV阳性妇女阴道镜检查分流策略,即时确认CIN3或CIN2,或更严重病变妇女
讨论
尽管特异性稍低,与液基细胞学检查相比HPV检测敏感性更高,3级或更高级别CIN检测敏感性提高,与前期欧洲4-6,35以及加拿大36(专门小组)临床试验结果一致。与单独HPV检测相比,液基细胞学检查联合HPV检测,>3级CIN检测敏感性提高不足5%,筛查阳性数量提高三分之一以上。与单独ASC-US或更严重细胞学异常的细胞学检查相比,将HPV16或HPV18检测作为一种附加性或替代性分流策略,用于重现性细胞学异常(LSIL或更严重病变,或HSIL或更严重病变),以及CIN3或更严重病变确认,检测结果更可靠(各实验室间),筛查阳性数量增加。
研究发现,将HPV检测作为初步筛查方法,进行疾病排除,使用特异性检测方法,如液基细胞学方法,确定即时阴道镜检査的妇女,应该是一种比较合理的液测方案。正如目前HPV与细胞学联合检测,以及细胞学筛査结果,HPV阳性妇女进行HPV检测或细胞学检査后,筛查即时阴道镜检查的妇女几乎相同,即均是HPV阳性,具有ASC-US,或LSIL或更严重病变。除外稀少的腺上皮不典型增生妇女,绝大多数LSIL或更严重病变妇女是HPV阳性,腺上皮不典型增生HPV阴性时,通常与子宫内膜异常,而不是子宫颈异常具有相关性。
研究结果表明,联合检测并不明显优于HPV单独检测。与HPV单独检测相比,>3级CIN妇女细胞学检查联合HPV检测安全性(NPV)提高有限(3066/3075,99.7%,95%CI 99.4-99.9对4299/4321,99.5%,95%CI 99.2-99.7: P=0.0137)
专门小组: 研究背景
系统回顾
已证明用于初步宫颈癌筛查的常规细胞学检査与 HPV DNA检测比较性能,5,6,36-38但无大样本筛査个体HPV16、HPV18基因型检测,或联合HPV DNA检测性能的研究报道。一项北美(加拿大与美国)与欧洲筛查研究综述表明: >2级CIN检测中,与细胞学检査方法相比, HPV DNA检测敏感性更高(96.1%对53.0%),但特异性稍低(90.7%对96.3%)。37筛查研究人群与 ATHENA人群年龄相当, HPV DNA检测通常使用 Hybrid Capture2。37同样,一项10000名妇女的加拿大研究结果表明: 与细胞学检查相比, >2级CIN HPV DNA检测敏感性更高(94.6%对55.4%),但特异性稍低(94.1%对96.8%)。36正如 ATHENA临床试验,所有ASC-US或更严重细胞学异常妇女,所有细胞学检查正常但HPV阳性高风险妇女,以及细胞学检査与HPV检测均阴性的妇女亚集均进行阴道镜检查,并进行相应调整,进行验证偏差处理。36宫颈癌筛查 HPV DNA检测整合算法研究中,相比于常规细胞学检查,初步 HPV DNA检测可在更早期检测出病变。5,6而且,初步 HPV DNA检测联合细胞学检查的分流检测,以及阴性细胞学检查结果的妇女进行重复HPV DNA检测,对于宫颈癌筛查来说,是一种更加现实的检测策略。
解读
ATHENA是美国最大规模的注册临床试验,用于进行宮颈癌筛查中,以液基细胞学检查为参照,对个体化HPV16、HPV18基因型,或两者联合HPV DNA检测性能进行评价。研究结果表明,与细胞学检查相比, HPV DNA检测敏感性更高: 与ASC-US或更严重细胞学检查相比,单独HPV16、HPV18,或两者检测敏感性相同: 与 ASC-US或更严重细胞学异常细胞学检查相比,低级别鳞状上皮内病变或更严重病变细胞学检查联合HPV16、HPV18基因型,或两者检测敏感性更高。宫颈癌筛查中,与目前的细胞学检查方案相比,HPV检测联合个体化HPV16、HPV18或两者基因型检测更加有效。
临床医生将HPV检测作为一线检测前,可能更倾向于联合检测,联合检测的潜在优势很难定量。40没有任何一种检测方法可准确地预防宫颈癌,从联合检测至单独HPV检测的转变,以及筛查间隔时间的确定最终取决于临床医生对风险的判断。
阴性细胞学检查结果、HPV阳性妇女临床诊断困难。有指南建议于1年内对阴性细胞学检查结果、HPV阳性妇女进行重筛查,15,44但这种筛査方式具有显著缺陷。首先,部分妇女已经患有>3级CIN,包括少部分但可观数量的没润性宫癌患者,第二,该人群随脱落率比较高(大约50%,16,45这样,就可抵销初步筛查HPV检测的较高的敏感性(非NPV)。上述情況下,需要施行分流检测策略。
流行病学研究表明,HPV16、HPV18检测或联合检检测可用于HPV阳性妇女,用于确定>3级CIN,即时明道镜检查妇女。研究发现,ASC-US或更严重细胞学异常检测、分流筛查即时阴道镜检查的HPV阳性妇女时,与液基细胞学检测方法相比,HPV16、HPV18检测,或联合检测效能相等或更加可靠。ASC-US是最常见的细胞学病变,但由于检测结果不确定,重现性很低。因此,液基细胞学方法进行ASC-US或更严重细胞学异常(通常大多数病例是ASC-US)检测,进行HPV阳性妇女分流检测,由于ASC-US室间差异,可导致检测性能差异较大。但部分地区如欧洲,由于集中管理相对于美国来说更高,质量控制更加严格,细胞学检测性能变异性较低。而且,HPV16与HPV18检测,风险测定比较客观,市场上己有cobas HPV检测,从而使算法管理整合更加容易。
有一种统计算法,ASC-US或更严重细胞学异常单独HPV16、HPV18检测,或联合检测进行阴道镜检查妇女分流,参考标准与HPV16或HPV18检测的HPV阳性、细胞学检查阴性妇女分流标准相同,15,47检测敏感性更高,但与ASC-US或更严重细胞学异常单独检测相比,PPV降低。与单独HPV16或HPV18检测,或单独ASC-US或更严重细胞学异常细胞学检查相比,联合最特异的严重病变(LSIL或更严重,或HSIL或更严重)细胞学检查与HPV16或HPV18检测,或两者联合,进行HPV阳性妇女分流,检测敏感性更高,PPV较好。医学专业小组将考虑到CIN3或更严重病变即时检测敏感性,过度转诊,以及PPV较低,以及此算法中保留细胞学检查所增加的成本问题,并进行权衡,最终决定首选或可被人们接受的HPV阳性妇女分流检测方法。而且,根据研究发现,我们建议进行HPV16、HPV18单独检测,或联合进行上述检测,并联合提高阈值性异常宫颈癌(LSIL或更严重病变)细胞学检查,进行HPV阳性妇女管理。
我们知道任何分流策略均不尽完美,从而部分CIN3或更严重病变妇女可能无法得到即时阴道镜检查,阴道镜检查可能会拖延至1年随访期内进行。例如: 如果采用HPV16或HPV18检测联合LSIL或更严重病变细胞学检查策路进行分流,相比于ASC-US或更严重细胞学异常细胞学检查策路的47.2%的HPV阳性的14.1%风险的CIN3或更严重病变妇女,27.8%的具有13.9%CIN3或更严重病变的HPV阳性妇女将会拖延至1年随访期内进行阴道镜检查(表4)。尽管所有HPV阳性女均进行即时阴道镜检查,可避免漏检,但过多的阴道镜转诊的增加可增加成本,从而使部分CIN2检测、治疗的发展倒退。考虑到敏感性与特异性,每种检测策略的选择均是权衡的结果。
我们同样也知道,此横向分析无法进行CIN3或腺癌原位HPV检测提前期检测优势定量,从而降低后续癌症发病率。但由于所有HPV阳性癌前病变均进行即时检测与治疗,降低了后续的癌症发病率与癌症相关死亡率,似乎比较符合逻辑的是,即时原位CIN3或腺癌检测与治疗率的增加,将最终降低癌症风险。然而,考虑到原位CIN3或腺癌发病率较低,此优势仅体现在大规模、有组织的项目中。
我们注意到,由于HPV阴性、细胞学检查阴性CIN3亚组识别、验证偏差矫正后,HPV检测与液基细胞学检测临床性能降低。加拿大HPV与Pap检测临床试验中,验证偏差调整后总体性能同样降低。36最可能的解释是,HPV与细胞学检测中,均遗漏此类稀少、真性CIN3或更严重病变,由于取样错误,导致双重假阴性结果。
或者,至少有部分病例有类似癌前病变的形态学改变,导致CIN3或更严重病变分类错误。50这些形态学类似病变不具有宫颈癌风险相关性,但由于我们无法准确地将它们与真性癌前病变进行区分,这些病变依然被纳入至我们的终点研究中。已诊断CIN3,但 cobas HPV检测与液基细胞学检测均阴性的妇女中,有4名p16免疫组化(德国海德堡mtm实验室)检测阴性,2名 Linear Arrav与 Amplicor HPV检测阴性。1名p16阳性病例Linear Array HPV检测HPV82检测阳性,1名HPV基因型,该基因型宮颈癌病例稀少,52因此不作为FDA批准检测靶点。因此大约半数HPV基因型,但非 cobas HPV检测靶点病例可能被误诊。由于密切筛查人群宫颈癌风险非常低,HPV与CIN3或更严重病变液基细胞学检查阴性病例不具有显著宫颈癌风险。即使有误诊病例纳入,HPN检测感性依然高于液基细胞学检查。
总之,根据我们的研究发现以及其他文献数据,我们建议合理进行HPV检测(单独HPV16、HPV18基因型检测或联合检测)联台或不联合液基细胞学检查,进行宫颈癌筛查,效益成本比、安全性较高。由于目前提供的 cobas HPV test HPV16与HPV18检测配备有其他致癌性HPV基因型样本池检测,与细胞学检查相比,HPV16与HPVI8检测的HPV阳性妇女分流将非常有效,并可降低对临床实验室的人力要求。我们同样建议,可弹性应用细胞学检查方法,仅针对HPV阳性非HPV16或HPV18基因型感染妇女,或仅针对需进行阴道镜检查的LSL或HSIL,或更严重病变妇女。通过进行单独HPV16、HPV18或联合检测,在保持PPV较高的前提下,上述检测策略将提高上述HPV阳性妇女CIN3或更严重病变检测敏感性。还需要进行深入研究,对不同宫颈癌检测策略的效益成本比进行性能比较评价,从而确定最佳检测策略。
作者
PEC设计,进行数据分析,并撰写本论文。MHS参与研究分析、数据解读、病理玻片审核,以及论文编辑。 TCWJr参与研究设计与分析、数据解读、病理玻片审核以及论文撰写与审核。AS指导进行数据分析。TILW进行研究设计、研究执行监管、数据分析监管、论文审核并进行评论,以及最终稿件审核。CMB参与研究施行、数据分析,以及论文撰写与编辑。
利益冲突
PEC就临床试验分析与罗氏公司签署有保密协议,但无财务补偿。MHS已收到罗氏分子系统咨询费与酬金,并是
BD、 Qiagen、Gen- Probe、 Ventana与默克公司的有偿顾问。 TCWJr已收到罗氏分子系统公司、mtm实验室、BD诊断公司、Gen- Probe与 Merck公司咨询费、酬金、演讲费,以及参加会议差旅性财务支持。AS、TLW与CMB是罗氏分子系统公司雇员,TLW拥有罗氏分子系统公司股权与认股权。
致谢
本研究得到了罗氏分子系统公司(美国加州Pleasanton)的资助。 Guili Zhang协助进行了数据分析。 Victoria Tomlinson(英国伦敦 Health Interactions公司)协助编辑工作,进行了论文最终稿的排版与校对。
 6376663254075307186558483.pdf
6376663254075307186558483.pdf